Különbség 1s és 2s között Orbital | 1s vs 2s Orbital
Kulcs különbség - 1s vs 2s Orbital
Atom az anyag legkisebb egysége. Más szavakkal, minden anyag az atomokból készül. Az atom szubatomos részecskékből, főleg protonokból, elektronokból és neutronokból áll. Protonok és elektronok alkotják a magot, amely az atom közepén helyezkedik el. De az elektronok olyan orbitálokon helyezkednek el (vagy energiaszinten), amelyek az atom magján kívül helyezkednek el. Fontos megjegyezni, hogy a pályák olyan hipotetikus fogalmak, amelyek az atom legvalószínűbb helyét magyarázzák. A magot körbeveszi különböző pályák. Vannak olyan szub-orbitálisok is, mint az s, p, d, f, stb. A szub-orbitális gömb alakú, ha 3D-s struktúrának tekintjük. Az orbitális legnagyobb valószínűsége, hogy egy elektronot találjon a mag körül. Az al-orbitális ismét számozva 1s, 2s, 3s, stb az energia szintek szerint. A legfontosabb különbség az 1s és 2s orbitális között az egyes orbitálisok energiája. 1s orbitális energiája kisebb, mint a 2s orbitális.
Tartalomjegyzék
1. Áttekintés és kulcskülönbség
2. Mi az 1s Orbital
3. Mi az a 2s Orbital
4. Side by Side Összehasonlítás - 1s vs 2s Orbital
5. Összefoglaló
Mi az 1s Orbital?
1s orbitális az orbitális, amely a legközelebb áll a maghoz. A legalacsonyabb energia az egyéb pályák között. Ez is a legkisebb gömb alakú. Ezért az orbitális sugara kicsi. Az orbitálisban csak 2 elektron lehet. Az elektron konfiguráció 1s 1 , ha csak egy elektron van a s orbitálisban. De ha van egy pár elektron, akkor írható 1s 2 . Ezután az orbitális két elektronja az ellenkező irányba mozdul el, mivel a két elektron ugyanazt az elektromos töltését okozza. Ha egy párosítatlan elektron van, paramágnesesnek nevezik. Ez azért van, mert egy mágnes vonzhatja. De ha az orbitális feltöltődik, és egy pár elektron van jelen, az elektronokat nem vonhatja el egy mágnes; ezt diamágnesesnek nevezik.
Mi a 2s Orbital?
A 2-es orbitális nagyobb mint 1s orbitális. Ezért a sugara nagyobb, mint az 1s orbitálisé. Ez a következő szekrény orbitális a magra az 1s orbitális után. Energiája nagyobb, mint 1s orbitális, de alacsonyabb, mint egy atom egy másik pályája. 2s orbitális is csak egy vagy két elektron tölthető fel. A 2-es orbitális azonban csak az 1s orbitális befejezése után töltődik fel az elektronokkal.Ezt az Aufbau-elvnek nevezik, amely az elektron-feltöltés sorrendjét jelzi az al-pályákon.
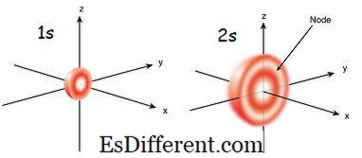
01. ábra: 1s és 2s Orbital
Mi a különbség az 1s és a 2s Orbital között?
- diff Artikel Közel a táblázat előtt ->
1s vs 2s Orbital |
|
| 1s orbitális a legközelebbi orbitális a maghoz. | 2s orbitális a második legközelebbi orbitális a maghoz. |
| Energiaszint | |
| Az 1s orbitális energia nagyobb, mint a 2s orbitálisé. | 2s viszonylag alacsonyabb energia. |
| Orbitális sugár | |
| Az 1-es orbitális sugara kisebb. | A 2-es orbitális sugara viszonylag nagy. |
| Az Orbital | |
| 1s orbitális mérete a legkisebb gömb alakú. | 2s orbitális nagyobb, mint az 1s orbitális. |
| Elektromos töltés | |
| Az elektronokat először töltik fel az 1s orbitálisan. | 2s orbitális csak az elektronok befejezését követően tölthető fel az 1s orbitálisban. |
Összefoglaló - 1s vs 2s Orbital
Egy atom egy olyan 3D struktúra, amely a közepén egy magot tartalmaz, különböző, különböző formájú alakzatokkal körülvéve. Ezek a pályák ismét kisugárzókra vannak osztva enyhe energia különbségeknek megfelelően. Ezekben az energiaszintekben helyezkedik el az elektronok, amelyek egy atom egyik legnagyobb szubatomikus részecske. Az 1s és 2s szub-orbitálisok legközelebb vannak a maghoz. A legfontosabb különbség az 1s és 2s pályák közötti különbség az energia szintje, vagyis a 2s orbitális energia magasabb, mint az 1s orbitális.
Referencia:
1. Libretexts. "Atomic Orbitals. "Chemistry LibreTexts. Libretexts, 03. november 2015. Web. 2017. május 26.
2. Atomok, elektronok és orbitálok. N. p., n. d. Web. 2017. május 26.
Kép jóvoltából:
1. "S pályák" (kivágott) A CK-12 Alapítvány - Fájl: High School Chemistry. pdf, 265. oldal (CC BY-SA 3. 0) Commons Wikimedia alatt


