Különbség az enzim és a koenzim között | Enzim vs koenzim
Kulcs különbség - enzim vs koenzim
A kémiai reakciók egy vagy több szubsztrátot alakítanak át termékekké. Ezeket a reakciókat speciális fehérjék katalizálja enzimként. Az enzimek a legtöbb reakció katalizátoraként szolgálnak anélkül, hogy fogyasztásra kerülnének. Az enzimek aminosavakból készülnek, és egyedi aminosavszekvenciákkal rendelkeznek, amelyek 20 különböző aminosavból állnak. Az enzimeket kis kofaktorokkal rendelkező, nem proteintartalmú szerves molekulák támogatják. A koenzimek egyfajta kofaktorok, amelyek segítik az enzimeket a katalízis végrehajtásában. Az enzim és a koenzim között a legfontosabb különbség az, hogy a enzim olyan fehérje, amely katalizálja a biokémiai reakciókat, míg a koenzim nem fehérje szerves molekula, amely segíti az enzimeket a kémiai reakciók aktiválásában és katalizálásában. Az enzimek makromolekulák, míg a koenzimek kis molekulák.
Tartalomjegyzék
1. Áttekintés és kulcskülönbség
2. Mi az enzim
3. Mi a koenzim
4. Side by Side Összehasonlítás - Enzim vs koenzim
5. Összefoglaló
Mi az enzim?
Az enzimek az élő sejtek biológiai katalizátorai. Ezek olyan fehérjék, amelyek több százmillió aminosavból állnak össze, mint például a gyöngyök. Mindegyik enzim egyedülálló aminosavszekvenciával rendelkezik, és meghatározza egy specifikus gén. Az enzimek felgyorsítják az élő szervezetek biokémiai reakcióit. Az enzimek csak a reakció sebességét befolyásolják, és jelenlétük elengedhetetlen a kémiai konverzió megkezdéséhez, mivel a reakció aktiválási energiáját enzimekkel csökkentik. Az enzimek a reakció sebességét megváltoztatják anélkül, hogy elfogynák, vagy a kémiai szerkezet megváltoztatása nélkül. Ugyanaz az enzim katalizálja az egyre több szubsztrátnak a termékekké való átalakulását oly módon, hogy megmutatja, képes-e ugyanazt a reakciót újra és újra katalizálni.
Az enzimek nagyon specifikusak. Egy adott enzim specifikus szubsztráthoz kötődik és egy specifikus reakciót katalizál. Az enzim specifitását az enzim alakja okozza. Mindegyik enzimnek van egy specifikus alakja és funkcionális csoportjaira specifikus kötésű aktív hely. Csak az adott szubsztrátum illeszkedik az aktív webhely alakjához és kötődik hozzá. Az enzim szubsztrátkötés specifikussága két hipotézissel magyarázható: a zár és a kulcshipotézis, valamint az indukált fithipotézis. A zárolás és a kulcshipotézis azt jelzi, hogy az enzim és a szubsztrátum közötti egyezés a zárhoz és a kulcshoz hasonló. Az indukált illeszkedés hipotézise azt mutatja, hogy az aktív hely alakja megváltozhat annak érdekében, hogy az adott hordozó alakja illeszkedjen a kézhez illő kesztyűkhez.
Az enzimreakciókat számos tényező befolyásolja, mint pl. A pH, a hőmérséklet stb. Minden enzimnek optimális hőmérsékleti értéke és pH-értéke van a hatékony munkavégzéshez. Az enzimek szintén kölcsönhatásba lépnek a nem fehérje kofaktorokkal, például protéziscsoportokkal, koenzimekkel, aktivátorokkal stb., A biokémiai reakciók katalizálása céljából. Az enzimeket magas hőmérsékleten vagy magas savassággal vagy lúgossággal el lehet pusztítani, mert fehérjék.

01. ábra: Az enzimaktivitás indukált fit modellje.
Mi a koenzim?
A kémiai reakciókat nem fehérje molekulák segítik, amelyeket kofaktoroknak neveznek. A kofaktorok segítik az enzimeket a kémiai reakciók katalizálásában. Különböző típusú kofaktorok és koenzimek egyike a köztük. A koenzim egy szerves molekula, amely egy enzim szubsztrátkomplexel kombinálva segít a katalizációs folyamatnak. Ezeket helper molekuláknak is nevezik . Vitaminokból vagy vitaminokból állnak. Ezért a tápláléknak olyan vitaminokat kell tartalmaznia, amelyek lényeges koenzimeket biztosítanak a biokémiai reakciókhoz.
A koenzimek kötődhetnek az enzim aktív helyéhez. Lazán kötődnek az enzimhez és segítik a kémiai reakciót a reakcióhoz szükséges funkcionális csoportok biztosításával vagy az enzim szerkezeti konformációjának megváltoztatásával. Ezért a hordozó kötődése könnyűvé válik, és a reakció a termékek felé irányul. Néhány koenzim másodlagos szubsztrátként működik, és kémiailag megváltozik a reakció végén, ellentétben az enzimekkel.
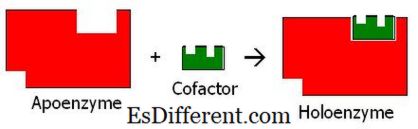
A koenzimek nem képesek kémiai reakciókat enzim nélkül katalizálni. Segítenek az enzimek aktívvá válásában és funkcióik ellátásában. Miután a koenzim kötődik a apoenzimhez, az enzim a holoenzim nevű enzim aktív formává válik és megindítja a reakciót.
A koenzimek példái közé tartoznak az adenozin-trifoszfát (ATP), a nikotinamid-adenin-dinukleotid (NAD), a Flavin adenin dinukleotid (FAD), az A koenzim, a B1, B2 és B6 vitamin stb. apoenzim
Mi a különbség az enzim és a koenzim között?
- diff Artikkel Közel a táblázat előtt ->
Enzim vs koenzim
Az enzimek olyan biológiai katalizátorok, amelyek felgyorsítják a kémiai reakciókat. |
|
| A koenzimek olyan szerves molekulák, amelyek segítik az enzimeket a kémiai reakciók katalizálásában. | Molekuláris típus |
| Az enzimek fehérjék. | |
| A koenzimek nem fehérjék. | Változások a reakciók miatt |
| Az enzimek nem változnak a kémiai reakció miatt. | |
| A koenzimek kémiailag megváltoznak a reakció eredményeként. | Specificitás |
| Az enzimek specifikusak. | |
| A koenzimek nem specifikusak. | Méret |
| Az enzimek nagyobb molekulák. | |
| A koenzimek kisebb molekulák. | Példák |
| Az amiláz, a proteináz és a kináz enzimek példái. | |
| NAD, ATP, koenzim A és FAD a koenzimek példái. | Összefoglaló - Enzim vs koenzim |
Az enzimek katalizálja a kémiai reakciókat. A koenzimek segítik az enzimeket a reakció katalizálásával az enzim aktiválásával és funkcionális csoportok biztosításával.Az enzimek aminosavakból álló fehérjék. A koenzimek nem fehérjék. Főleg vitaminokból származnak. Ez az enzimek és koenzimek közötti különbség.
Referencia:
1. „Enzimek. "RSC. N. p., n. d. Web. 2017. május 15.
2. "Strukturális biokémia / enzim / koenzimek. "Structural Biochemistry / Enzyme / Coenzymes - Wikikönyvek, nyílt könyvek egy nyitott világ számára. N. p., n. d. Web. 2017. május 15.
Kép jóvoltából:
1. "Indukált illesztési diagram" A TimVickers által létrehozott, Fvasconcellos által vektorizált - TimVickers (Public Domain) által biztosított Commons Wikimedia
2. "Enzimek" A Moniquepena - Saját mű (Public Domain) a Commons Wikimedia alatt



