Különbség az alifás és aromatikus szénhidrogének között | Aliphatic vs Aromatic Hydrocarbons
Kulcskülönbség - Alifás és aromás szénhidrogének Először röviden nézzük meg, hogy a szénhidrogének melyik alifás és aromás szénhidrogén. A szénhidrogének a szén- és hidrogénatomokat tartalmazó szerves vegyületek. Az alifás és aromás szénhidrogének
kulcsfontosságú különbsége alifás szénhidrogének nem tartalmaznak konjugált kötési rendszert míg aromás szénhidrogének tartalmaznak egy konjugált kötésrendszert. Mindkét molekula azonban szerves vegyületnek tekintendő. ->
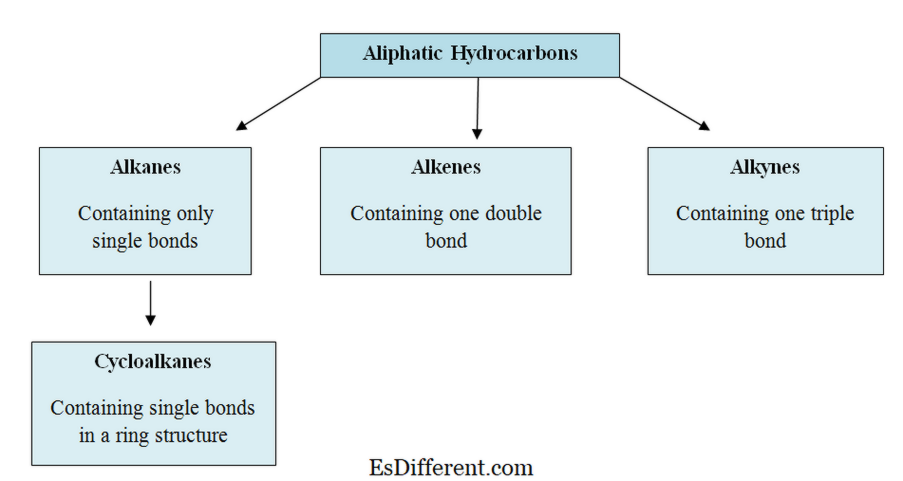
Mi azAlifás szénhidrogének ? Az alifás szénhidrogének a szén (C) és hidrogén (H) atomokat tartalmazó szerves molekulák; egyenes láncokban, elágazó láncokban vagy nem aromás gyűrűkben. Az alifás szénhidrogének három fő csoportba sorolhatók; alkánok, alkének és alkinok.
Aromás szénhidrogének ? Aromás szénhidrogéneket néha "
aréna " vagy " aril szénhidrogének " néven ismerik. A legtöbb aromás szénhidrogén szerkezetükben benzolgyűrűt tartalmaz; de vannak heteroarének nevezetű benzol-aromás szénhidrogének, amelyek a Huckle szabály
követését követõ ciklikus gyûrûknek 4n + 2 π-elektronok, ahol n = 0, 1, 2, 3, 4, 5, 6). Egyes aromás szénhidrogéneknek több gyűrűje van; ezeket
policiklusos aromás szénhidrogének
-nek nevezik.
Tipikus policiklusos aromás szénhidrogének leírása. Mi a különbség az Aliphatic és az aromás szénhidrogének között?
Az alifás és aromatikus szénhidrogének szerkezete

Alifás szénhidrogének:
Ezek szerkezetükben egyenes láncúak, elágazó láncok vagy nem aromás gyűrűk. Ez a csoport mind telített, mind telítetlen szénhidrogéneket tartalmaz. Alkánok telített szénhidrogének, alkének és alkinok telítetlen szénhidrogének.

Egyenes láncok:

Octán
Márkás láncok:

5-etil-3-metil-oktán 2-metil-3-pentencén
Aromás szénhidrogének:
Az aromás szénhidrogének szerkezetükben aromás gyűrűs rendszert tartalmaznak. Ezek mind telítetlen szénhidrogének, de viszonylag stabilak a konjugált kötésrendszer miatt. Alifás és aromás szénhidrogének kategóriái Alifás szénhidrogének:
Az alifás szénhidrogének három fő csoportja van; alkánok, alkének és alkinok. Ezeket allil szénhidrogének

-nek is nevezik. Alkanes:
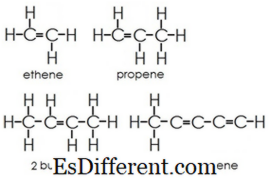
Az alkánokban a szén- és a hidrogénatomok egyetlen kötéssel kapcsolódnak egymáshoz. Nem rendelkeznek több kötéssel. Az alkánok gyűrűszerkezeteket alkotnak, ezeket cikloalkánoknak nevezik. Alkenesek

: Ez a csoport egyszerre és kettős kötést tartalmaz a szénatomok között. A hidrogén és a szén-atomok mindig egyetlen kötést alkotnak.
Alkynes:

Az alkinok az egyes kötések mellett hármas kötést tartalmaznak a szénatomok között.
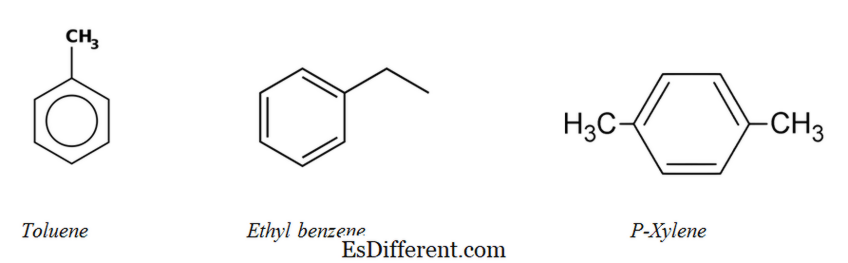
Aromás szénhidrogének:
Az aromás szénhidrogének többsége legalább egy benzolgyűrűt tartalmaz szerkezetükben. De kevés nem benzolos aromás szénhidrogén van, ezeket "heteroaréneknek" hívják. Az aromás szénhidrogéneket "aril" szénhidrogéneknek nevezzük.
Bifenil (aromás szénhidrogén két benzolgyűrűvel)
Alifás és aromás szénhidrogének ragasztási mintája
Alifás szénhidrogének:
Alifás szénhidrogénekben; egyetlen, kettős vagy hármas kötés létezhet bárhol a molekulában. Néha többféle struktúra létezhet egy molekuláris formula esetében a többszörös kötés (ek) helyzetének megváltoztatásával. Ezek a molekulák lokalizált elektronrendszert tartalmaznak.
Aromás szénhidrogének:
Az aromás szénhidrogénekben alternatív egy- és kettőskötési rendszer van ahhoz, hogy konjugált kötésrendszert hozzon létre egyes elektronok delokalizálására. (A delokalizált elektronok egy kötéstől a másikig mozoghatnak).
Alifás és aromás szénhidrogének reakciói
Alifás szénhidrogének:
A telített szénhidrogének szubsztitúciós reakciók; a telítetlen szénhidrogének addíciós reakcióval érik el a stabilitást. De bizonyos reakciók ellenőrzött körülmények között történnek, anélkül, hogy több kötést feltörnének. Aromás szénhidrogének: Az aromás szénhidrogének telítetlenek, de stabil konjugált elektronrendszerrel rendelkeznek, így jobban hajlamosak szubsztitúciós reakciókra, mint addíciós reakciókra. Képtár: "Policiklusos aromás szénhidrogének" az Inductiveload által - Feltöltő saját munkája, az Accelrys DS Visualizer. (Public Domain) keresztül a Commons



