Különbség az alkánok és az alkén között | Alkanes vs Alkene
Kulcskülönbség - Alkanes vs Alkenes
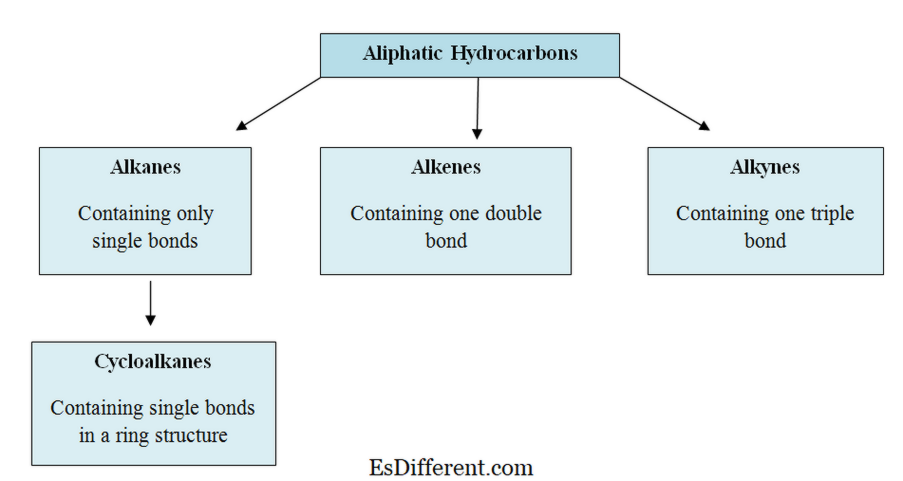
Alkánok és alkének kétféle szénhidrogéncsalád, amelyek molekuláris szerkezetében szenet és hidrogént tartalmaznak. Az alkánok és az alkének között a legfontosabb különbség a kémiai szerkezet; az alkánok a C n H 2n + 2 általános molekuláris képletü telített szénhidrogének, és az alkének jelentése telítetlen szénhidrogéncsoport, mivel kettős kötést tartalmaznak két szén atomok. A C n H 2n általános molekuláris formula.
Mi az Alkanes?Az Alkanes csak egyetlen kötést tartalmaz a szén- és hidrogénatomok között (C-C kötések és C-H kötések). Ezért "telített szénhidrogéneknek" hívják. Az orbitális hibridizációs modell szerint az alkánok összes szénatomja az SP
3 hibridizációval rendelkezik. Heterociklusos kötést alkotnak a hidrogén atomokkal, és a kapott molekula tetraéder geometriájával rendelkezik. Az Alkanét molekuláris elrendezése szerint két csoportra osztható; aciklikus alkánok (C n H 2n + 2 ) és ciklikus alkánok (C n H 2n ).

Az alkének szénhidrogének, amelyek szén-szén (C = C) kettős kötést tartalmaznak.
"Olefinek" a régi név, amely az alkéncsaládra utal. E család legkisebb tagja az etán (C 2 H 4 ); oleum azt jelenti, hogy "olaj" + "facere" azt jelenti, hogy "kész") a korai napokban. Ennek oka, hogy a C 2 H 4 és a klór C 2 H 2 Cl 2 olaj.

n
H
2n + 2. Metán (CH 4 ) a legkisebb alkán. Aciklikus szerkezet Metán CH
4| CH | 4 | Ethán C |
| 2 | H 6 | CH 3 |
| CH | 3 Propán C 3 | H 8 CH 3 |
| CH | 2 CH 3 Bután | C 4 H 10 CH 3 CH |
| 2 | CH 2 CH 3 | A pentán C 5 H 12 CH 3 CH |
| 2 | CH 2 CH 2 | CH 3 hexán C 6 H 14 CH 3 CH 2 |
| CH | 2 CH 2 CH | 2 CH 3 heptán C 7 H 16 CH 3 CH 2 |
| CH | 2 CH 2 CH 2 | CH 2 CH 3 Octane C 8 H 18 CH 3 CH 3 CH |
| 2 | CH 2 CH 2 | CH 2 3 CH 3 Alkenesek: Az alkének általános kémiai képlete a C n H 2n .Az alkéneket telítetlen szénhidrogéneknek tekintik, mivel nem tartalmaznak olyan hidrogénatomok maximális számát, amelyek szénhidrogén molekulák tulajdoníthatók. Név Kémiai képlet Struktúra Ethene C 2 |
H 4 CH 2 = CH 2
| C | 3 | H |
| 6 | CH 3 CH = CH 2 | Butén C 4 H |
| 8 | CH 2 = CHCH 2 | CH 3, CH 3 |
| CH = CHCH 3 | Pentén C 5 H | 10 CH 2 = CHCH 2 CH 2 3, CH |
| 3 | CH = CHCH 2 CH 3 | Hexén C 6 H 12 CH 2 = CHCH 2 CH 2 CH 2 CH 3 |
| CH | 3 CH = CHCH 2 CH | 2 CH 3 CH 3 CH 2 CH = CHCH 2 CH 3 heptén C 7 H 14
CH = CHCH < 2 CH 2 CH 2 CH 2 CH |
| 3 | CH 3 CH = CH < 2 CH | 2 CH 2 CH 2 CH 3 Alkánok és alkének kémiai tulajdonságai Alkanes: Reakciókészség: Az alkánok sok kémiai reagenssel szemben inertek. Ez azért van, mert a szén-szén (C-C) és a szén-hidrogén (C-H) kötések meglehetősen erősek, mivel a szén- és hidrogénatomok közel azonos elektronegativitási értékekkel rendelkeznek. Ezért igen nehéz megszakítani kötéseit, hacsak nem elég magas hőmérsékleten melegítik. Égés: Alkánok könnyen éghetnek a levegőben. Az Alkánok és a felesleges oxigén közötti reakciót "égésnek" nevezik. Ebben a reakcióban az alkánok széndioxidra (CO 2 ) és vízre konvertálódnak. C n H 2n + (n + n / 2) O 2 → n CO 2 + 2 |
C
4 H
10
+ 13/2 O
2
→ 4 CO 2 + 5H 2
O Bután Oxigén Szén-dioxid Víz Az égési reakciók exoterm reakciók (hőt termelnek). Ennek eredményeképpen az alkánokat energiaforrásként használják. Alkének: Reakciókészség: Az alkének hidrogénnel reagálnak finom eloszlású fémkatalizátor jelenlétében, így a megfelelő alkánt kapják. A reakció sebessége nagyon alacsony katalizátor nélkül. Katalitikus hidrogénezést alkalmaznak az élelmiszeriparban, hogy a folyékony növényi olajokat félig szilárd zsírvá alakítsa a margarin és a szilárd zsírok előállítása során. Alkánok és alkének fizikai tulajdonságai Formák Alkánok: Alkánok gázok, folyadékok és szilárd anyagok formájában léteznek. A metán, az etán, a propán és a bután szobahőmérsékleten gáz. A hexán, pentán és heptán nem elágazó szerkezetei folyadékok. A nagyobb molekulatömegű alkanok szilárdak.
CH 4 C 4 H 10 gázok C 5 H 12
C
17
H
36
folyadékok és
Nagy molekulatömegű alkánok lágy szárazanyag
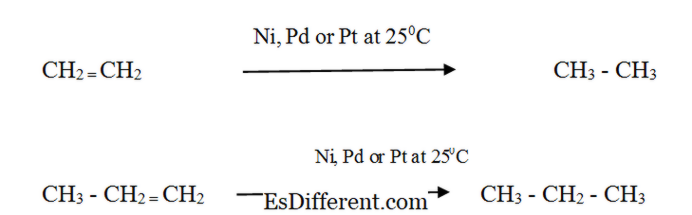
Alkének:
Az alkének a megfelelő alkán hasonló fizikai tulajdonságait mutatják. Az alacsony molekulatömegű alkének (C
2 H
4 toC 4 H 8 ) gázok szobahőmérsékleten és atmoszferikus nyomáson.A nagyobb molekulatömegű alkének a szilárd anyagok. Oldékonyság:
Alkánok: Alkánok nem oldódnak vízben. Nem poláris vagy gyengén poláros szerves oldószerekben oldódnak fel. Alkének: Az alkének viszonylag poláris molekulák a C = C kötés miatt; ezért nem poláris oldószerekben vagy alacsony polaritású oldószerekben oldódnak. A víz poláris molekula, és az alkének vízben kevéssé oldhatók. Sűrűség: Alkanes: Az Alkanes sűrűsége alacsonyabb, mint a víz sűrűsége. Sűrűségük közel 0, 7 g -1 , figyelembe véve a víz sűrűségét, mint 0,1 g
-1
. Alkének: Az alkének sűrűsége alacsonyabb, mint a víz sűrűsége. Forrási pontok: Alkánok: A nem elágazó alkánok forráspontja egyenletesen növekszik, amikor a szénatomok száma és a molekulatömeg növekszik. Általában az elágazó láncú alkánok alacsonyabb forrásponttal rendelkeznek a nem elágazó alkánokkal összehasonlítva, ugyanolyan számú szénatomot hordoznak. Alkenesek : A forráspontok hasonlóak a megfelelő alkánokhoz, kis változatban. Referenciák: CliffsNotes. (d.). Elhozva 2016. július 6-tól, innen.
Alkanes fizikai tulajdonságai. (2013). A 2016. július 6-án letöltött, innen
Zum Directory-modus. (d.). 2010. 06. 06., beszerezve innen: Az Alkanes kémiai tulajdonságai: Wizznotes. com- Ingyenes GCSE és CXC: oktatóanyagok, múltbeli dokumentumok és kvízek. (d.). A 2016. július 6-án letöltött, innen
Polaritás. (d.). Megnyitva 2016. július 6-tól, innen Dipole moments. (2013). Megszerezve 2016. július 6-án, innen
Strukturális izomer. (d.). Elhozva 2016. július 6-tól, innen
Bevezetés az alkénekhez. (d.). Image Alkalmazás: "Alkene nevek" Chris Evans - (CC0) a Commons Wikimedia alatt "Telített C4 szénhidrogének ball-and-stick" Fvasconcellos - Saját munka Public Domain) a Commons Wikimedia alatt