Különbség a nem megfelelő javítás és a nukleotid kiváltás javítása között | Nem megfelelő javítás vs nukleotid kivágás javítása
Kulcskülönbség - Nem megfelelő javítás vs nukleotid kiváltás javítás
A sejtben naponta tíz és több ezer DNS károsodik. Ez megváltoztatja a sejtfolyamatokat, például a replikációt, a transzkripciót és a sejt életképességét. Bizonyos esetekben az ilyen DNS-károsodások által okozott mutációk káros, például rákos megbetegedésekhez és öregedéshez társuló szindrómákhoz vezethetnek (pl. Progeria). Függetlenül attól, hogy ezek a károsodások, a sejt egy nagyon szervezett kaszkád javító mechanizmust indít DNS-károsodásnak. Számos DNS-javító rendszert azonosítottak a sejtrendszerben; ezek a következők: Base excision repair (BER), Mismatch repair (MMR), Nucleotide excision repair (NER), Double strand break javítás. A nukleotid excíziós javítás rendkívül sokoldalú rendszer, amely felismeri a terjedelmes helix torzítás DNS-sérüléseit, és eltávolítja őket. Másrészről, a nem megfelelő javítás helyettesíti a misincorporált bázisokat a replikáció során. A mismatch repair és a nukieotid excision javítás között a legfontosabb különbség az, hogy nukleotid excision repair (NER) az UV besugárzás és a kémiai adduktumok által okozott terjedelmes hélix elváltozások által előidézett pirimidin dimerek eltávolítására használják, miközben a mismatch repair rendszer fontos szerepet játszik a misincorporált bázisok, amelyek a reprodukciós enzimekből (DNS polimeráz 1) megszöktek a reprodukció során. Az eltérõ bázisok mellett az MMR rendszerfehé- tei meg tudják javítani az ismétlõdõ DNS-szekven- ciák replikációja során a polimeráz-csúszás eredményeként létrejött insertions / deletions hurkokat (IDL).
Tartalomjegyzék
1. Áttekintés és kulcskülönbség
2. Mi az eltérés-javítás
3. Mi a nukleotid kiváltás javítása
4. Side by Side Összehasonlítás - Nem megfelelő javítás vs nukleotid kiváltás javítás
5. Összefoglaló
Mi az a Nucleotide Excision Repair?
A nukleotid excíziós javítás legkülönbözőbb jellemzője, hogy javítja a DNS-kettős hélix jelentős torzulásai által okozott módosított nukleotid károkat. Szinte minden olyan szervezetben megfigyelhető, amelyet naprakészen vizsgáltunk. Uvr A, Uvr B, Uvr C (excinukleázok) Uvr D (egy helikáz) a legismertebb enzimek, amelyek a NER-ben szerepet játszanak, és kiváltják a DNS javítását az Ecoli modellel. Az Uvr ABC több alegységű enzimkomplex termeli az Uvr A, Uvr B, Uvr C polipeptideket.A fent említett polipeptidekre kódolt gének a következők: uvr A, uvr B, uvr C. Az Uvr A és B enzimek együttesen felismerik a károsodott indukált torzítást, amelyet az UV-sugárzás miatt a DNS kettős hélixhez, például pirimidin dimmerhez okoznak. Az Uvr egy ATPáz enzim, és ez egy autokatalitikus reakció. Ezután az Uvr A elhagyja a DNS-t, míg az Uvr BC komplex (aktív nukleáz) a DNS mindkét oldalán megragadja az ATP által katalizált károsodást. Egy másik Uvr D nevű fehérje, amelyet az uvrD gén kódolt, egy helikális II enzim lefejti az egyszálú sérült DNS szegmens felszabadulását eredményező DNS-t. Ez a rés a DNS-hélixben marad. A károsodott szegmens kivágása után 12-13 nukleotid rés marad a DNS-szálban. Ezt az I DNS polimeráz enzimet töltik be, és a nicket a DNS-ligázzal lezárják. ATP szükséges a reakció három lépése során. A NER mechanizmus azonosítható az emlősökhöz hasonló emberekben is. Emberben a Xeroderma pigmentosum nevű bőrállapot az UV sugárzás által okozott DNS-dimereknek köszönhető. A XPA, XPB, XPC, XPD, XPE, XPF és XPG gének DNS-károsító hatású fehérjéket termelnek. Az XPA, XPC, XPE, XPF és XPG génjeinek nukleinsavaktivitása van. Másrészt az XPB és XPD gének fehérjéi olyan helikázaktivitást mutatnak, amely az Uvr D analógjai E coli.

01. ábra: Nucleotide Excision repair
Mi az illesztő javítás?
A hibás javítási rendszert a DNS-szintézis során indítottam. Még a funkcionális € alegységgel is, a DNS polimeráz III lehetővé teszi, hogy minden 10 8 bázispár esetében a nem megfelelő nukleotid beépüljön a szintézisbe. A nem megfelelő javító fehérjék felismerik ezt a nukleotidot, kivessznek és helyükbe a helyes nukleotidot, amely a végső pontossági fokért felelős. A DNS-metilezés az MMR fehérjék számára kulcsfontosságú az új szintetizált szálból származó szülői szál felismeréséhez. Az új szintetizált szál GATC motívumában lévő adenin (A) nukleotid metilezése kissé késik. Másrészről a GATC-motívumban a szülői szál-adenin-nukleotid már metilált. Az MMR fehérjék felismerik az újonnan szintetizált szálat, ezzel a különbséggel a kiindulási szálból, és az újonnan szintetizált szálon megkezdődik a nem megfelelő javítás, mielőtt metilezettvé válik. Az MMR fehérjék a javítási tevékenységüket a rossz nukleotid kivágására irányítják, mielőtt az újonnan replicált DNS-szálat metiláltatják. A Mut H, Mut L és Mut S enzimek mut mutálják mutációikat H, mut L, mut S katalizálja ezeket a reakciókat Ecoli-ban. A Mut S fehérje felismeri a nyolc lehetséges eltérés nélküli bázispár közül hétet, kivéve a C: C-t, és a duplex DNS-ben kötődik a mismatch helyén. Megkötött ATP-k, Mut L és Mut S csatlakoznak később a komplexhez. A komplex néhány ezer bázispárral áthelyeződik, amíg hemimetilezett GATC motívumot nem talál. A Mut H fehérje nyugvó nukleázaktivitása aktiválódik, ha hemimetilált GATC motívumot talál. Megszűri a nem metilált DNS-szálat, amely 5 'nick-ot hagy maga után a nem metilált GATC motívum G nukleotidjához (új szintetizált DNS-szál).Ezután a mátrix másik oldalán ugyanazt a szálat a Mut H. dobja. A lépések többi részében az Uvr D helikázprotein, a Mut U, az SSB és az exonukleáz kollektív hatásai kizárják a helytelen nukleotidot az egyszálú DNS-t. A kivágásban kialakuló rést a DNS polimeráz III tölti ki, és ligázzal lezárja. Hasonló rendszer azonosítható egerekben és emberekben. Az emberi hMLH1, hMSH1 és hMSH2 mutációja az örökletes nem-polipózis vastagbélrákban szerepet játszik, amely deregulálja a vastagbél-sejtek sejtosztódását.
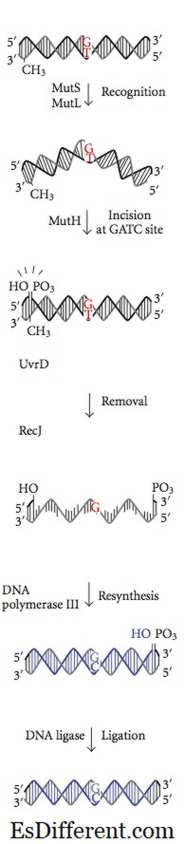
02. ábra: Nem megfelelő javítás
Mi a különbség a nem megfelelő javítás és a nukleotid excision javítás között?
- diff A cikk előtti táblázat ->
Nem megfelelő javítás vs nukleotid kiváltás javítása |
|
| Az eltérés javítási rendszere a post-replikáció során fordul elő. | Ez vonatkozik a pirimidin dimerek eltávolítására az U. V besugárzás és a kémiai adduktum következtében fellépő egyéb DNS-elváltozások miatt. |
| Enzimek | |
| A katalizátorok a Mut S, a Mut L, a Mut H, az Uvr D, az SSB és az I. exonukleáz enzim katalizálja. | Uvr A, Uvr B, Uvr C, UvrD enzimek katalizálja. |
| Methylation | |
| A reakció elindítása kulcsfontosságú. | DNS-metiláció nem szükséges a reakció elindításához. |
| Enzimek hatása | |
| Mut H egy endonukleáz. | Uvr B és Uvr C exonukleázok. |
| Occasion | |
| Ez különösen a replikáció során történik. | Ez történik, ha az U. V vagy a kémiai mutagén hatásának van kitéve, nem pedig a replikáció során. |
| Conservation | |
| Nagyon konzervált | Nem nagyon konzervált. |
| Hézagkitöltés | |
| Ezt a DNS polimeráz III végzi. | Ezt a DNS-polimeráz I végzi. |
Összefoglaló - Nem megfelelő javítás vs nukleotid kiváltás javítás
Nem megfelelő javítás (MMR) és nukleotid excision repair (NER) két mechanizmus, amely a cellában történik, DNS-károsodások és torzulások, amelyeket különböző anyagok okoznak. Ezek együttesen DNS-javító mechanizmusok. A nukleotid excíziós javítás megjavítja a módosított nukleotid károsodásokat, jellemzően azon DNS kettős hélix jelentős károsodását, amelyek az U. V besugárzásnak és a kémiai adduktumoknak való kitettség miatt következnek be. A nem megfelelő javító fehérjék felismerik a rossz nukleotidot, kivesszük, és helyes nukleotiddal helyettesítjük. Ez a folyamat felelős a végső fokú pontosságért a replikáció során.
Referencia:
1. Cooper, Geoffrey M. "DNS javítás. "A sejt: molekuláris megközelítés. 2. kiadás. U.S. Orvostudományi Könyvtár, 1970. január 01. Web. 2017. 09. 09.
2. "A DNS mismatch javításának mechanizmusa és funkciói. "Cell kutatás. U. S. National Medicine Library, n. d. Web. 09. mar. 2017.
Kép kedvesen:
1. "Nucleotide Excision Repair-folyóirat. pbio. 0040203. g001 "Által Jill O. Fuss, Priscilla K. Cooper - (CC BY 2.5) Commons Wikimedia alatt
2. "DNS mismatch repair Ecoli" Kenji Fukui - (CC BY 4. 0) a Commons Wikimedia alatt



