A monatom és a diatomás közötti különbség | Monatomikus vs diatomás
A monatomos és a diatomás közötti különbség elsősorban a fajban jelen lévő atomokra vonatkozik. Amint a nevek azt sugallják, mindkét kifejezés az atomi egyesületek különböző állapotaira utal, ahol a "mono" kifejezés azt jelenti, hogy "egy" és "di" jelentése "kettő". "Ezért egyszerűen monatomikusan egy"
egy atom "és kétatomos" két atomot jelent. ' Azonban az alapvető definíciónak annyi különböző lehet.
Mi a Monatomic?Ha
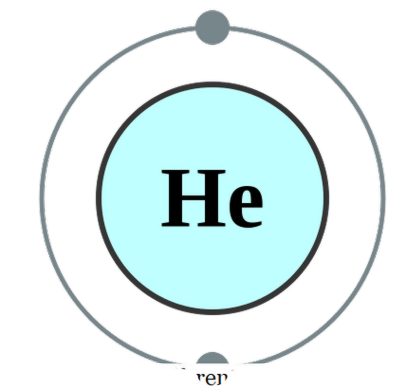
egyetlen atom létezik saját (ami ritkán fordul elő), akkor monatomikusnak nevezzük. Ez azt jelenti, hogy az elemek tiszta szinguláris formájukban vannak. Az egyetlen gyakorlati példa, amely ebbe a kategóriába tartozhatna, a nemes gázok, amelyek magukban atomokként léteznek, mivel a külső héjuk egy oktett elektronokkal van kiegészítve. Ezért nem akarnak több elektront elfogadni vagy adományozni annak érdekében, hogy stabilabbak legyenek. Ezért a nemesgázok monatomos formában stabilak. Néhány példa; Ő - Hélium, Ne - Neon, Ar - Argon, Xe - Xenon, Kr - Krypton, Rn - Radon.
Mi a diatomás?
Ha
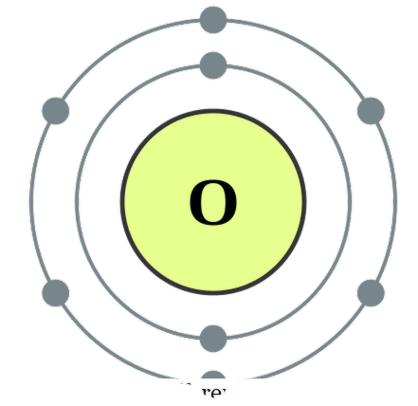
két atom egymáshoz kapcsolódik , akkor diatomnak nevezzük. Ezek az atomok lehetnek azonos típusúak vagy különbözőek. Ha két egymáshoz hasonló atom van, akkor " homonukleáris diatoma " -nek nevezzük, és ha különböző típusúak, akkor " heteronukleáris diatómák ". Néhány homonukleáris diatoma esetében példák lehetnek O2, N2, H2 stb., Míg a CO, NO, HCI, stb. Példák a heteronukleáris diatómákra. Oxigén
A diatómák tekinthetők vegyületeknek, mivel ezek az egyesületeket alkotják annak érdekében, hogy nagyobb stabilitást érjenek el az elektronok egymással való megosztásával, hogy mindkét atom elérje a nemesgáz-elektronikus konfigurációt. Kovalens kötéseken köthetők az atomos pályák átfedésén keresztül, vagy pedig ionos kötéseket alkothatnak közöttük, ami a pozitív töltésű faj és a negatív töltésű faj között vonzó erő. A diatómák között kovalens kötésekre példaként említhető a CO, NO, stb., És a HCl ionos vonzás jellegű fajnak tekinthető. Mivel azonban a H + és Cl- vonzási erő nem túl erős, ez nem egy nagyon jó példa az ionkötésekre, ez egy másik téma.
Mi a különbség a Monatomic és a Diatomic között?
• A monatomikus fajoknak egy atomjuk van, míg a diatomiaknak két atomjuk van.
• A monatomikus fajok általában nem stabilak, de a diatomiak általában stabilak.
• A nemesgázok csak monatomikusak és nem találhatók diatomi formában.
• Kémiai kötések vannak a diatomi fajok között, míg monatomos fajokban nincs kötés.
Képek jóvoltából:
Hélium elektron konfiguráció Pumbaa (CC BY-SA 2. 0 uk)
- Oxigén elektron konfiguráció DePiep (CC BY-SA 3. 0)




