Különbség a részleges nyomás és a gőznyomás között
Részleges nyomás és gőznyomás a rendszerösszetevők által gyakorolt nyomás mértékével kapcsolatos tudományos fogalmak, de identitásuk zavaró lehet mások számára. Világos különbség van ezek között a kifejezések között, beleértve hatásukat és azonosságukat. Ez a cikk többet fog kidolgozni e fogalmak közötti különbségekről. Ez magában foglal néhány példát annak alkalmazásainak demystifikálására.
Kezdjük azzal, hogy kiemeljük a nyomás fogalmát, mielőtt a gőz és a parciális nyomás közötti különbségtétbe belenyúlhatnánk. A nyomást tudományosan úgy definiálják, mint egy tárgy vagy anyag egységterületén alkalmazott erő. Azt is meg lehet határozni, mint az egymással ütköző részecskék által alkalmazott erő, amelyet gyakran a Pascal alkalmazásával mérnek. A részecskék ütközésénél a gáz egyenletét és a gázok kinetikus elméletét használják a nyomás kiszámításához.
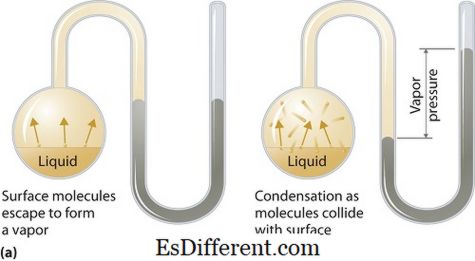
Mi a gőznyomás?
Gőznyomás alkalmazható folyékony vagy szilárd fázisokra. A gőz által termodinamikai egyensúlyban lévő folyadék vagy szilárd állapot nyomása egy adott hőmérsékleten zárt rendszerben történik, amikor mind a gőz, mind a folyadék (szilárd) érintkezésben áll. Ez a nyomás a párolgás következtében keletkezik, amelyet a szilárd vagy folyadék fokozott hője teszi lehetővé. Így a hőmérsékletet a párologtatás mértékeként alkalmazzuk és közvetlenül arányos a gőznyomással. Ez azt jelenti, minél magasabb a hőmérséklet, annál nagyobb a gőznyomás.
A párolgás során a légmolekulák a magasabb kinetikus energia eredményeként távoznak a levegőbe zárt rendszerben. Akkor, amikor egyensúlyban van, a gőznyomás keletkezik a gőz és a kondenzált folyadékforma (szilárd) között. Olyan megoldásoknál, ahol az intermolekuláris erők gyengébbek, a gőznyomás nagyobb, és fordítva, olyan oldatokban, ahol az intermolekuláris erők erősebbek, a gőznyomás kisebb.
A gőznyomás is ideális keverékekben fordulhat elő, amint azt a Raoult törvénye is kifejti. Megállapítja, hogy valamely folyékony vagy szilárd keverékben lévő adott komponens részleges gőznyomása megegyezik az adott komponens gőznyomásával szorozva az adott keverékben lévő mólfrakcióval egy adott hőmérsékleten. Az alábbi példa bemutatja, hogy.
1. példa.
Az ideális keverék 0, 5 mol. etanol és 1,5 mol. metanol 30 kPa és 52 kPa gőznyomással meghatározza az egyes komponensek parciális gőznyomását.
Megoldás:
A molszám teljes mennyisége 1. 5mol + 0. 5mol = 2. 0mol. A Raoult törvény értelmében a parciális gőznyomás egyenlő a gőznyomással, szorozva az adott komponens moláris frakciójával.Ebben az esetben a P metanol = 1. 5/2 * 52 = 39KPa és P etanol = 0. 5/2 * 30 = 7. 5KPa.
Ha a keverékben lévő komponensek parciális gőznyomása van, akkor a teljes gőznyomást összeadhatjuk. Ebben a tekintetben a 7. 5 + 39 az etanol és metanol oldatok keverékének összesített gőznyomása 46,5 kPa-t tesz ki.
A gőznyomást befolyásoló tényezők
Molekulák azonosítása
Amint már említettük, a molekuláris erők típusai határozzák meg a gőznyomás mértékét. Ha az erők erősebbek, akkor kevesebb gőznyomás alakul ki, és ha gyengébb, akkor nagyobb a gőznyomás. Ezért a folyadék vagy szilárd anyag összetétele befolyásolja a gőznyomást.
Hőmérséklet
A magasabb hőmérséklet magasabb gőznyomást eredményez, mivel több kinetikus energiát aktivál a molekuláris erők megtörésére, hogy a molekulák gyorsan el tudják menekülni a folyadékot. Ha a gőznyomás (telített gőznyomás) megegyezik a külső nyomással (légköri nyomás), a folyadék forrni kezd. Az alacsonyabb hőmérséklet alacsony gőznyomást eredményez, és a folyadék forrni fog.

Dalton törvényes részleges nyomás
Mi a részleges nyomás?
A parciális nyomás eszméjét először a híres John Dalton tudós javasolta. Ez hozta létre a részleges nyomás törvényét, amely kimondja, hogy az ideális gázkeverék által kifejtett teljes nyomás egyenlő az egyes gázok részleges nyomásának összegével. Mondjuk, hogy egy adott tartály hidrogén-, nitrogén- és oxigéngázzal van feltöltve, a teljes nyomás, P TOTAL, egyenlő lesz az oxigén, a nitrogén és a hidrogén összegével. Az adott keverék bármely gázának parciális nyomását úgy számolják ki, hogy a teljes nyomást megszorozzák az egyes gáz móltöredékével.
Dióhéjban a parciális nyomás egy adott gáz által a keverékben kifejtett nyomás, mintha csak a rendszerben működne. Így Ön figyelmen kívül hagy más gázokat az egyes gázok részleges nyomásának meghatározásakor. Ezt az elméletet ellenőrizni lehet például 0, 6atm O 2 egy 10,0 literes tartályban egy 230K-nál, majd injektálva 0,44 N 2 egy azonos tárolóedénybe ugyanolyan méretűek ugyanabban a hőmérsékleten, majd végül összevonják a gázokat a teljes nyomás mérésére; ez lesz a két gáz összege. Ez egyértelműen megmagyarázza az egyedi gáz részleges nyomását nem reaktív gázok keverékében.
A parciális nyomás kiszámítása
A parciális nyomás kiszámítása abszolút szellő, hiszen a Dalton törvénye [1] erre vonatkozó rendelkezéseket tartalmaz. Ez a tipikus tájékoztatástól függ. Ha pl. Az A és B gáz keverékére, valamint az A gáz nyomására teljes nyomást adunk meg, akkor a B parciális nyomását P TOTAL = P A + P B . A többi algebrai manipuláció. De abban az esetben, ha csak a keverék teljes nyomását adták, a B gáz moláris frakcióját alkalmazhatjuk a részleges nyomás meghatározására.Az X jelzésű moláris frakció a B gázban levő mólok elosztásával a gázkeverék összes móljaival osztható meg. Ezután a részleges nyomás megtalálásához az X moláris frakciót összeadjuk a teljes nyomással. Az alábbi példa azt mutatja be.
2. példa.
A nitrogén és oxigén keverékét 2,5 mol és 1,85 mol moláris mennyiségben injektáljuk egy 20,0 literes tartályba, 4 perc teljes nyomás mellett; kiszámítja az oxigéngáz által kifejtett parciális nyomást.
Megoldás:
A keverékben a mólok száma összesen 2,5 + 1. 85 = 4,35 mól. Tehát az oxigén moláris frakciója, X o , 1,85 mol / 4 lesz. 35 mól = 0,425 mól. Az oxigén parciális nyomása 0,425 * 4tm = 1,7m. A fennmaradó gáz részleges nyomása ugyanazon megközelítés alapján számítható ki, vagy kiszámítható az oxigéngáz és a teljes nyomás hatására, ahogy azt a Dalton Részleges Nyomásai törvénye kifejtette, hogy a nem reaktív gázok összes nyomása megegyezik a a részleges nyomás.
A gőz és a parciális nyomás közötti különbség
A fenti magyarázatokból látható, hogy a gőznyomás és a parciális nyomás két különálló nyomás. A gőznyomás folyékony és szilárd fázisokra vonatkozik, míg a részleges nyomás a gázfázisra vonatkozik. A gőznyomást fázisátalakításban fejtik ki, miután elégséges hőt adtak az oldathoz, és ezáltal a molekulái eljutottak egy zárt rendszerben.
A parciális nyomás és a gőznyomás közötti fő különbség az, hogy a parciális nyomás a keverékben lévő egyes gázok által kifejtett nyomás, mintha csak a rendszerben lenne, miközben a gőznyomás a gőz által a termodinamikai egyensúly a folyadék vagy szilárd anyag kondenzált állapotával. Az alábbi táblázat tömören összehasonlítja ezeket a nyomásokat.
| Gőznyomás | Részleges nyomás |
| Folyékony vagy szilárd gőzöket kondenzált fázisban egyensúlyi állapotban | Az egyes gázok nem reaktív gázkeverékben |
| Jól magyarázzák a Raoult Jog | jól magyarázható Dalton törvény |
| Szilárd és folyékony fázisokban | Csak gázfázisban alkalmazható |
| Független a felszíntől vagy a rendszer térfogatától | A gázok felhasználásával számítva térfogat |
| Az oldott anyag moláris frakciójával számolva | A gáz mólfrakciójával számolva |
Wrap Up!
A gőznyomás és a parciális nyomás két fontos tudományos kifejezés, amelyeket a gőz és a gázok által adott erők hatásának meghatározására használnak adott zárt rendszerben, adott hőmérsékleten. Fő különbségük a folyékony vagy szilárd fázisú gőznyomás alkalmazási területe, miközben a részleges nyomást egy egyedi gázra egy adott térfogatú ideális gázok keverékében alkalmazzák.
A parciális nyomást a Dalton Részleges Nyomású Törvényének követésével könnyen kiszámítjuk, míg a gőznyomást a Raoult törvényének alkalmazásával számítjuk ki.Minden egyes keverékben minden gázkomponens saját nyomást fejt ki, amelyet más gázoktól független parciális nyomásnak neveznek. És ha megduplázol minden komponenst a maradék hőmérsékleten, növelni fogja a parciális nyomását. Clausius-Clapeyron viszony [2] szerint a gőznyomás nő, ahogy a hőmérséklet nő.
A fent említett információkkal meg kell tudnia különböztetni a gőznyomást és a parciális nyomást. Önnek képesnek kell lennie kiszámítani őket a moláris frakciók felhasználásával és a teljes nyomással szorozni. Tipikus példákat adtunk Önnek arra, hogy kidolgozzák e nyomások alkalmazását.


