Különbség a protetikus csoport és a koenzim között | Prosthetic Group vs Coenzyme
Kulcs különbség - protetikus csoport vs koenzim
Az enzimek az élő sejtekben előforduló kémiai reakciók biológiai katalizátorai. Néhány enzimhez helper molekulák vagy partner molekulák szükségesek a biokémiai reakciók katalizálására. Ezek a molekulák kofaktorokként ismertek. A kofaktorok nem fehérje molekulák, amelyek segítik a kémiai reakciókat. Segítenek a reakció sebességének növelésében. A kofaktor lehet szervetlen vagy szerves. Ezek különböző típusú molekulákból állnak, mint például a vitaminok, a fémionok, a nem vitaminos molekulák stb. A protetikus csoport és a koenzim kétféle segédmolekula enzim. A protetikai csoport és a koenzim közötti különbség az, hogy a protetikai csoport szorosan kötődik az enzimhez a enzimhez, míg a koenzim lazán kötődik egy enzimhez katalitikus funkciójának támogatásához. A protetikus csoportok lehetnek szerves molekulák vagy fémionok, míg a koenzimek teljesen szerves molekulák.
Tartalomjegyzék
1. Áttekintés és kulcskülönbség
2. Mi a protetikus csoport
3. Mi a koenzim
4. Oldalankénti összehasonlítás - protéziscsoport vs koenzim
5. Összefoglaló
Mi a protetikus csoport?
A protéziscsoport olyan kofaktor, amely szorosan kötődik az enzimhez, és segíti a kémiai reakció katalizálását. Ezek nem fehérje molekulák. Kisebb szerves molekulák vagy fémionok lehetnek. Az enzimhez való szoros kötődés miatt a protéziscsoportokat nehéz eltávolítani az enzimektől. Ezért úgy ítélik meg, hogy a protetikai csoport és az enzim közötti kötődés tartós a koenzimektől eltérően. A kötéskor strukturális elemekként vagy töltőhordozóként működhetnek. Például a hemoglobin és a mioglobin prosztata csoportja hemént teszi lehetővé a szövetek követelményeinek megfelelő kötést és az oxigén felszabadulását. Vannak olyan vitaminok, amelyek protéziscsoportként hatnak az enzimekre.
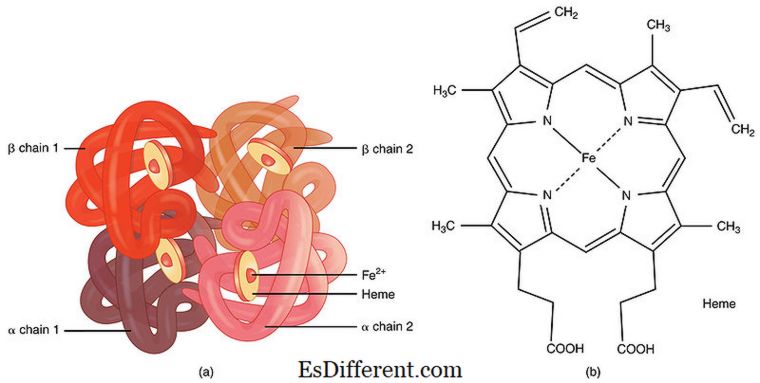
01. ábra: Prosthetic group heme hemoglobin molekulában
Mi a koenzim?
A koenzim egy specifikus típusú kofaktor, amely segíti az enzimeket a funkciójuk ellátásában. Ők részt vesznek a reakció sebességének növelésében. A koenzimek olyan nem fehérjék, amelyek enzimekkel dolgoznak. Ezek kis szerves molekulák (széntartalmú molekulák), amelyek többnyire vitaminokból származnak. Lazán kötődnek az enzim aktív helyéhez, és segítenek nekik a szubsztrátok felismerésében, vonzásában és visszaszorításában.A koenzim jelenléte elengedhetetlen bizonyos enzimek számára a katalitikus funkció megkezdéséhez és elvégzéséhez. Közbenső hordozóként és koszorúrokként is működnek.
A koenzimek nem specifikusak az enzimek szempontjából. Különböző típusú enzimekkel kötődhetnek, és segítenek kémiai reakciók végrehajtásában. Ezért újrafelhasználhatóak. Ezek a koenzimek megváltoztathatják struktúráikat alternatív formákká, ha ez elengedhetetlen. A koenzimek nem működhetnek egyedül. Meg kell kötődnie az enzimmel. Ha egy koenzim kötődik a apoenzimhez, akkor holoenzim lesz, amely az enzim aktív formája, amely katalizálja a kémiai reakciókat.
A koenzimek példái közé tartoznak a C-vitamin, a B-vitamin, az S-adenozil-metionin, az ATP, a koenzim A stb.

02. ábra: Coenzim
Mi a különbség a prosztata csoport és a koenzim között?
- diff Artikkel Közel a táblázat előtt ->
Protetikus csoport vs koenzim |
|
| A protetikus csoport egy helper molekula egyik típusa, amely egy nemproteinmentes vegyület, amely segíti az enzimeket feladatainak ellátásában. | A koenzim egy specifikus kofaktor-molekula, amely egy szerves molekula, amely segíti az enzimeket a kémiai reakciók katalizálásában. |
| Enzimekkel kötött kötés | |
| Az enzimek elősegítése érdekében szorosan vagy kovalensen kötődnek enzimekkel. | Lazán kötődnek az enzim aktív helyéhez, hogy segítsenek a katalitikus működésben. |
| Összetétel | |
| A protetikus csoportok fémionok, vitaminok, lipidek vagy cukrok. | A koenzimek vitaminok, vitaminszármazékok vagy nukleotidok. |
| Főfunkció | |
| A protéziscsoport főleg az enzimhez strukturális tulajdonságot biztosít. | A koenzim főként funkcionális tulajdonságot biztosít az enzim számára. |
| Az enzim eltávolítása | |
| A protetikus csoportokat nem lehet könnyen eltávolítani az enzimektől. | A koenzimek könnyen eltávolíthatók az enzimekből. |
| Példák | |
| Példák a flavin nukleotidokra és a hemekre. Példák: AMP, ATP, koenzim A, FAD és NAD | + , S-adenozil-metionin Összefoglaló - Protetikus csoport vs koenzim |
A kofaktorok az enzimek segítő molekulái. Ezek nem fehérjék, és szervetlen vagy szerves molekulák. A koenzimek és protéziscsoportok kétféle helper molekula. A koenzim egy szerves molekula, amely lazán kötődik enzimekkel a reakciók elősegítése érdekében. A protézis csoport egy szerves molekula vagy egy fém vas, amely szorosan vagy kovalensen kötődik az enzimhez a kémiai reakciók elősegítésére. Ez a különbség a protetikus csoport és a koenzim között. Mindkét csoport újra felhasználható és nem specifikus az enzimekre.
Referencia:
1. "Cofactor (biokémia). "Wikipedia. Wikimedia Alapítvány, 2017. május 14. Web. 2017. május 17.
2. Klucevsek, Kristin. Coenzimek, kofaktorok és protetikus csoportok: Funkció és kölcsönhatások. "Tanulmányozz. com. Tanulmány. com, n. d. Web. 2017. május 17. // study. com / Academy / óra / koenzimek-kofaktorok-prosztetikus-csoportok-funkció-és-kölcsönhatások. html
3. Helmenstine, Ph. D. Anne Marie. "Mi a koenzim? Meghatározás és példák."ThoughtCo. N. p., n. d. Web. 2017. május 17.
4. Hashim, Onn H. és Nor Azila Adnan. "Koenzim, kofaktor és protetikai csoport - Kétértelmű biokémiai zsargon. "Biokémiai oktatás. Headington Hill Hall, 2010. június 30. Web. 2017. május 17
Kép jóvoltából:
1. "1904 Hemoglobin" A OpenStax College - Anatómia és élettan, Connexions webhelyen. 2013. június 19. (CC BY 3. 0) Commons Wikimedia alatt


