Különbség a savas bázis titrálás és a redox titrálás között | Acid-bázis titrálás vs redox titrálás
kulcs különbség - savas bázis titrálás vs. redox titrálás
titrálást alkalmaznak egy ismeretlen oldat (analit) koncentrációjának meghatározására. A leggyakrabban használt két titrimetriás módszer a savas bázis titrálások és redox titrálások. A savas bázis titrálások és a redox titrálások kulcskülönbsége a titráló titráló és a analit között a reakció természete. A savas bázis titrálásoknál semlegesítő reakció zajlik le, és redox titrálásoknál redox reakció történik (oxidáló reakció és redukciós reakció). A mutatók használata a legáltalánosabban használt módszer a reakció végpontjának meghatározására.
Mi az a savalap-titrálás?
A savas bázis titrálásakor titrálunk savat (savas titrálást) vagy egy bázist (bázikus titrálást). A savas titrálásokban alkalmazott savak példái a H 2 SO 4 , HCI vagy HNO 3. A leggyakrabban használt alap titánok a NaOH, K 2 CO 3 vagy Na 2 CO 3. A savas bázis titrálások az alábbiak szerint sorolhatók a sav és a bázis szilárdságától függően.
- Erős savas - erős bázis titrálások
- Erős savas gyenge bázis titrálások
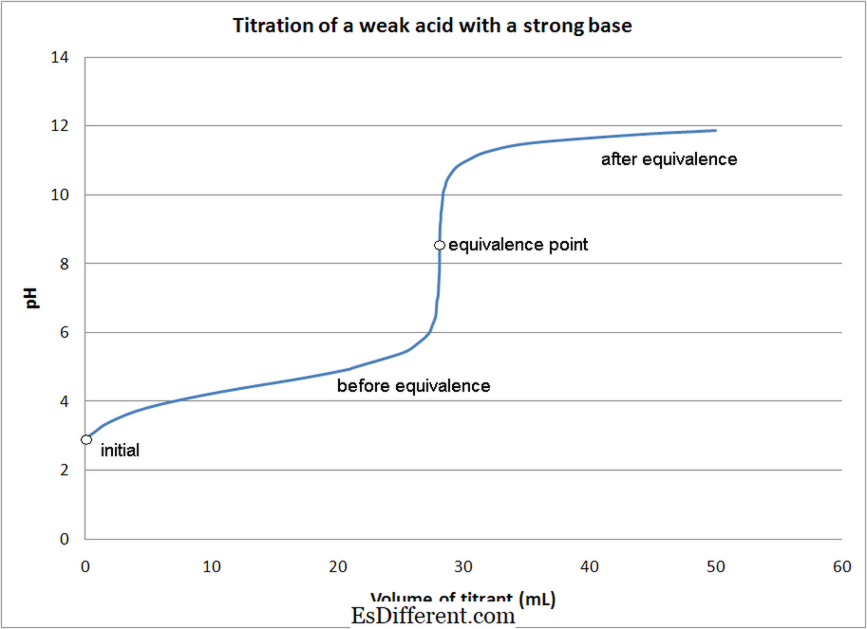
- Gyenge sav - erős bázis titrálások
- Gyenge sav - gyenge bázis titrálások
A legtöbb savban -alapú titrálást, a reakció végpontjának meghatározására mutatókat használunk. Különböző mutatókat használnak a titrálás típusától függően, mint fent említettük.
Mi a Redox titrálás?
A redox titrálás redox reakciót tartalmaz. A redox reakciónak két reakciója van; egy oxidációs reakciót és egy redukciós reakciót. Mind az oxidációs, mind a redukciós folyamatok ugyanabban az időben zajlanak le, amikor lehetővé teszik számunkra a reakció befejezésének meghatározását. Ez a titrálás végpontjaként is ismert. Ezt számos módon lehet meghatározni; indikátor elektródákkal, redox jelzőkkel (az indikátor eltérő színt ad oxidációcsökkentő állapotban), és nem redox indikátorok (az indikátor színt ad, ha túl sok titrát adnak hozzá).

Mi a különbség a savalapú titrálás és a redox titrálás között?
A reakció természete:
Savas bázis titrálás: A savas bázis titrálással az elemzõ (az ismeretlen koncentrációjú oldat) és a savas vagy bázikus titráló közeg semlegesítési reakciót von maga után.
Redox titrálás: A redox reakció az oxidációs és redukciós reakciót tartalmazza az analit és a titráló között. Nincs ilyen szabály, hogy az összetevő oxidálódik, és melyik csökkenti. Az analit vagy a titráló oxidálódik, és a fennmaradó komponens ennek megfelelően csökken.
A végpont meghatározása:
Savas bázis titrálás: Általánosságban a sav-bázis titrálás végpontjának meghatározására pH-jelzőt, pH-mérőt vagy vezetőképességmérőt alkalmazunk.
Redox titrálás: A redox reakció végpontjának meghatározására legáltalánosabban használt módszerek egy potenciométer vagy egy redox indikátor. De leggyakrabban az analit vagy a titráló a végponton színt ad. Így további mutatókra nincs szükség ezeknél az esetekben.
Példák:
Savas-bázis titrálás:
| Erős sav-erős bázis titrálás | HCI + NaOHàNaCl + H |
| 2 | O (fenolftalein / metil- narancs) Erős sav - gyenge bázis titrálás HCI + NH |
| 3 | à NH 3 Cl (metil-narancs) 3 |
| COOH + NaOHà CH | 3 COONa + H 2 O (fenolftalein) Gyengén savas nyers titrálás CH 3 |
| - + NH 4 + (Nincs megfelelő mutató) COOH + NH 3 Redox titrálás: 2 KMnO 4 + 5 H 2 |
C
2 O 4 + 6 HCI → 2 MnCl 2 + 2KCl + 10 CO 2 + 8 H 2 O (+3) (+2) 4) A fenti reakcióban a permanganát csökkent, míg az oxálsav oxidálódik. Amikor a reakció teljessé válik, a permanganát lila színe színtelenül változik. KMnO 4 + 5FeCl 2
+ 8HCI
→
5FeCl 3 + MnCl 2 + KCl + 4H 2 O (+ 7) (+2) (+3) (+2) Kép jóvoltából: 1. A gyenge sav titrálása erős bázissal A Quantumkinetics (Saját munka) [CC BY 3. 0], a Wikimedia Commons-ban 2. "Winkler Titrálás Előző titrálása" Willwood [CC BY-SA 3. 0] via Commons




