Különbség ionos és kovalens vegyületek között | Ion és kovalens vegyületek
Kulcs különbség - ionos vs. kovalens vegyületek
Számos különbség figyelhető meg ionos és kovalens vegyületek között makroszkopikus tulajdonságaik, például oldhatóságuk víz, elektromos vezetőképesség, olvadáspont és forráspont. Ezeknek a különbségeknek a fő oka a kötésminta különbsége. Ezért kötési mintázatuk kulcskülönbségnek tekinthető ionos és kovalens vegyületek között. (Az ionos és a kovalens kötések közötti különbség) Amikor ionos kötéseket képeznek, az elektronokat / fémeket adományozzák, és az adományozott elektronokat nemfém elfogadja. Az elektrosztatikus attrakció miatt erős kötést alkotnak. Kovalens kötéseket alakítanak ki két nemfém között. Kovalens kötésben két vagy több atom osztja meg az oktont az oktet szabályának kielégítésére. Általában az ionos kötések erősebbek, mint a kovalens kötések. Ez fizikai tulajdonságaik közötti különbségekhez vezet.
Mi az ionos vegyületek?
Ionos kötések keletkeznek, ha két atom nagy eltérést mutat az elektronegativitási értékeikben. A kötés kialakulásának folyamata során az elektron (oka) és az elektronelektromos atomok kevésbé elektronegatív atomvesztesége az elektron (oka) t kapja. Ezért az így létrejövő fajok ellentétesen feltöltött ionok és kötődnek az erős elektrosztatikus attrakciónak köszönhetően.
Ionkötések keletkeznek a fémek és a nemfémek között. Általában a fémek nem rendelkeznek több valens elektronnal a legkülső héjban; azonban a nemfémek közelebb vannak a nyolc elektronhoz a valence héjban. Ezért a nemfémek elfogadják az elektronokat, hogy megfeleljenek az oktet szabálynak.
A ionos vegyületre vonatkozó példa Na + + Cl - à NaCl A nátrium (fém) csak egy vegyérték elektron és a klór (nemfém) hét valence elektron.

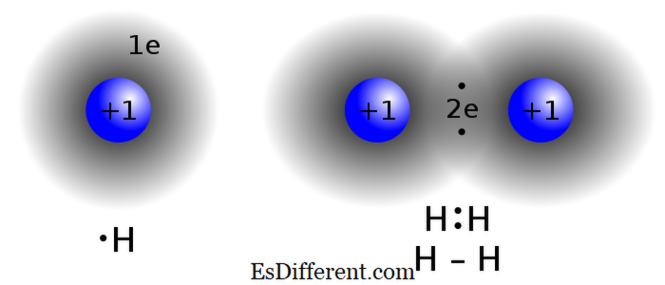
A kovalens vegyületeket úgy alakítják ki, hogy kettő vagy több atomot osztanak el az "oktett szabály" kielégítésére. Ezt a kötési típust általában a nemfém vegyületek, az azonos vegyület atomjai vagy közeli elemei találják az időszakos táblában. Két atom, amelyek közel azonos elektronegativitási értékekkel rendelkeznek, nem cserélnek (adományoznak / fogadnak) az elektronokat a valence héjuktól. Ehelyett osztoznak az elektronok, hogy elérjék a oktett konfigurációt.
Példák a kovalens vegyületekre
a metán (CH 4 ), szénmonoxid (CO), jód-monobromid (IBr) kovalens kötés
Mi a különbség ionos és kovalens vegyületek?
Ionvegyületek és kovalens vegyületek meghatározása
Ionvegyület:
Az ionos vegyület kationok és anionok kémiai vegyülete, amelyek ioncsatlakozásokkal vannak összekötve egy rácsszerkezetben. Kovalens vegyület:
A kovalens vegyület egy kémiai kötés, amely egy vagy több elektron, különösen az elektronok párosa, atomok közötti megosztásával jön létre. Ion és kovalens vegyületek tulajdonságai
Fizikai tulajdonságok
Ionvegyületek:
Minden ionos vegyület szobahőmérsékleten szilárd anyagként létezik.
Az ionos vegyületek stabil kristályszerkezettel rendelkeznek. Ezért magasabb olvadáspontjaik és forráspontjukik vannak. A pozitív és a negatív ionok vonzereje nagyon erős.
Olvadáspont| NaCl - Nátrium-klorid | Fehér kristályos szilárd anyag | 801 ° C |
| KCl - Kálium-klorid | Fehér vagy színtelen üvegtiszta kristály | 770 ° C |
| MgCl | 2 | - Magnézium-klorid |
| Fehér vagy színtelen kristályos szilárd anyag 1412 ° C Kovalens vegyületek: Kovalens vegyületek mindhárom formában léteznek; mint szilárd anyagok, folyadékok és gázok szobahőmérsékleten. | Olvadáspontjuk és forráspontjuk viszonylag alacsony az ionos vegyületekhez képest. | Kovalens vegyület |
Megjelenés
Olvadáspont
HCI-hidrogén-klorid
| Színtelen gáz | -114. 2 | CH |
| 4 | -Metán | Színtelen gáz |
| -182 ° C CCl 4 | - Szén-tetraklorid | -23 ° C |
| Vezetőképesség Ionvegyületek: A szilárd ionos vegyületek nem rendelkeznek szabad elektronokkal; ezért nem szilárd formában végzik a villamos energiát. De ha az ionos vegyületeket feloldjuk vízben, olyan oldatot készítünk, amely elektromos áramot hoz létre. Más szavakkal, az ionos vegyületek vizes oldata jó elektromos vezető. | Kovalens vegyületek: | Sem tiszta kovalens vegyületek, sem vízben oldott formák nem vezetnek villamos energiát. Ezért a kovalens vegyületek gyenge elektromos vezetékek minden fázisban. |
Oldékonyság
Ionvegyületek: Az ionos vegyületek többsége vízben oldódik, de nem poláros oldószerekben oldhatatlan.
Kovalens vegyületek: A legtöbb kovalens vegyület oldható nem poláros oldószerekben, de nem vízben.
Keménység
Ionvegyületek: Az ionos szilárd anyagok keményebb és törékeny vegyületek.
Kovalens vegyületek: Általában a kovalens vegyületek lágyabbak, mint az ionos szilárd anyagok.



