Különbség az Alpha Helix és a Beta görbe lapok között | Alpha Helix és Beta laposlap
Kulcskülönbség - Alpha Helix vs Beta Platós
Az alfa hélixek és a béta hullámosított lapok a polipeptidlánc két leggyakrabban talált másodlagos szerkezete. Ez a két strukturális komponens az első fő lépés a polipeptidlánc hajtogatásának folyamatában. Az kulcskülönbség az Alpha Helix és a Beta görbe lapok között struktúránkban ; két különböző formájuk van ahhoz, hogy egy adott munkát végezzenek.
Mi az Alpha Helix?
Az alfa hélix a polipeptidlánc jobbkezes aminosavmaradékja. Az aminosavmaradékok tartománya 4 és 40 aminosav között változhat. A felső tekercs C = O csoportjának oxigénje és az alsó tekercs N-H csoportjának hidrogénje között létrejött hidrogénkötések segítik a tekercs együtt tartását. A fenti módon minden egyes négy aminosavcsoporton hidrogénkötést képezünk. Ez az egységes minta határozza meg a meghatározott jellemzőket, például a tekercs vastagságát, és meghatározza a hélix tengely mentén minden egyes teljes fordulatot. Az alfa hélix szerkezet stabilitása számos tényezőtől függ.

Vörös atomok, N atomok kékben, hidrogénkötések zöld szaggatott vonalként
Mi a Beta plántált lap?
Béta hullámosított lap, más néven béta-lap, a fehérjék másodlagos struktúrájának második formája. Béta-szálakat tartalmaz, amelyek oldalán legalább két vagy három gerinc hidrogénkötéssel vannak összekötve, hogy a képen látható csavart, hajtogatott lapot képezzen. A béta-szál egy polipeptidlánchossz; hossza általában 3-10 aminosavnak felel meg, beleértve a gerincet kiterjesztett megerősítéssel.
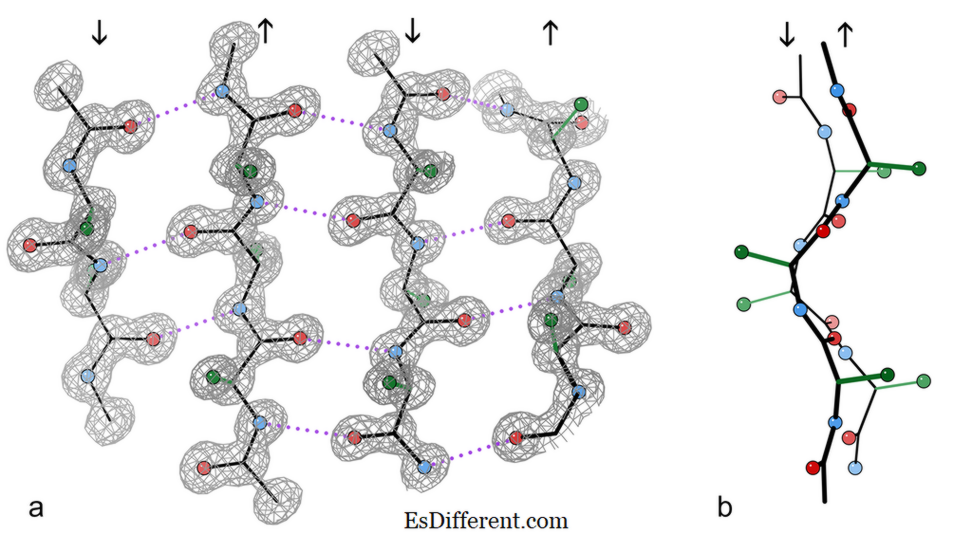
4-szálú antiparallel β lemezréteget tartalmaz a kataláz enzim kristályszerkezetéből.
a) az NH-peptid és a CO-csoportok közötti szomszédos szálak közötti párhuzamos hidrogénkötések (szaggatott) bemutatása. A nyilak jelzik a lánc irányát, és az elektron sűrűségű kontúrok felvázolják a nem-H atomokat. O atomok piros golyók, N atomok kékek, és a H atomok egyszerűségét elhagyják; oldalhosszúságok csak az első sidechain C atomra jelennek meg (zöld)
b) A középső két β szál szegélyezett nézete
A béta hajtogatott lapokban a polipeptidláncok egymás mellé futnak. A szerkezet hullámszerű megjelenése miatt kapta a nevét "hullámosított lap". Ezek hidrogénkötésekkel kapcsolódnak egymáshoz.Ez a szerkezet lehetővé teszi a hidrogénkötések kialakulását a polipeptidlánc nyújtásával.
Mi a különbség az Alpha Helix és a Beta Pleated Sheet között?
Alpha Helix és Beta Platós szerkezete
Alpha Helix:
Ebben a struktúrában a polipeptid gerinc spirális struktúrához szorosan kötődik egy képzeletbeli tengely körül. A peptidlánc spirális elrendezésének is ismert.
Az alfa hélix szerkezet kialakulása akkor történik, amikor a polipeptidlánc spirálba csavarodik. Ez lehetővé teszi, hogy a lánc összes aminosava hidrogénkötést (oxigén-molekula és hidrogén-molekula közötti kötést) képezzen egymással. A hidrogénkötések lehetővé teszik, hogy a spirál tartsa a spirál alakját és szűk tekercset biztosítson. Ez a spirál alakja az alfa hélixet nagyon erősvé teszi.
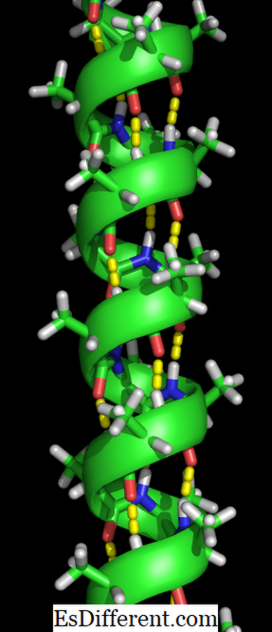
A hidrogénkötéseket a sárga pontok jelzik.
Bétaplasztikai lap:
Ha két vagy több polipeptidlánc (ok) fragmense egymással átfedésben van, és egy sor hidrogénkötést képeznek egymással, a következő struktúrák találhatók. Kétféle módon történhet meg; párhuzamos elrendezés és párhuzamos elrendezés.
Példák a szerkezetre:
Alpha Helix: A körmök vagy a lábujjak példaként szolgálhatnak az alfa hélix szerkezetére.
Béta laposlap: A tollak szerkezete hasonló a béta hajtogatott lap szerkezetéhez.
A szerkezet jellemzői:
Alpha Helix: Az alfa hélix szerkezetben a spirál elfordulása után 3,66 aminosav van. Az összes peptidkötés transz és sík, és a peptidkötésekben lévő N-H csoportok ugyanabba az irányba mutatnak, ami megközelítőleg párhuzamos a hélix tengelyével. Az összes peptidkötés C = O csoportja az ellenkező irányba mutat, és párhuzamos a hélix tengelyével. Az egyes peptidkötések C = O csoportja a hidrogénkötést képező peptidkötés N-H csoportjához kapcsolódik. Minden R-csoport a hélixről kifelé mutat.
Béta laposlap: A bétafátyolozott lap minden peptidköve sík, transzformációval rendelkezik. A szomszédos láncok peptidkötéseinek C = O és N-H csoportjai ugyanabban a síkban helyezkednek el egymás felé, egymás felé pedig hidrogénkötést hozva létre közöttük. Valamennyi lánc összes R-csoportja alternatív módon a lap síkja felett és alatt helyezkedhet el.
Meghatározások:
Másodlagos struktúra: Ez egy összehajtogató fehérje alakja, amely a gerinc amid és a karbonilcsoport közötti hidrogénkötésnek köszönhető.
Referenciák: "Protein Structure". ChemWiki: A dinamikus kémiai hiperszöveg "fehérje másodlagos szerkezete: α-Helices és β-Sheets". Proteinstructures. com által Salam Al Karadaghi "Organic Chemistry". A virtuális sejtes tankönyv "Beta Sheet". Wikipedia Image Courtesy: "Helix elektronsűrűség myoglobin 2nrl 17-32" A Dcrjsr - Saját munkák (CC BY 3. 0) a Commons Wikimedia alatt "Protein secondary structure" által en: Felhasználó: Bikadi (CC BY-SA 3. 0) via Commons Wikimedia "1z antipar béta lap mindkettő" Dcrjsr - Saját munka (CC BY 3.0) Commons Wikimedia alatt



