A különbség a kiegyensúlyozott egyenlet és a nettó ion egyenlet között | Kiegyensúlyozott egyenlet vs nettó ionegyenlet
Kulcskülönbség - Egyensúlyi egyenlet vs nettó ionegyenlet
Minden kémiai reakció egyenletként írható. Ennek az egyenletnek a komponensei közé tartoznak a fizikai állapotukkal rendelkező reaktánsok, egy nyíl a reakció irányának és a reakciótermékeknek fizikai állapotukkal való kimutatására. Ha bármilyen speciális körülményt alkalmaztak, röviden a nyilakra is rákérdeznek. Ha a reakció egyensúlyban van, két fél nyilat használnak ellentétes irányban. A kémiai egyenlet kétféleképpen írható: egyenletes egyenletként vagy nettó ionegyenletként. A kiegyensúlyozott egyenlet és a nettó ionegyenlet között a legfontosabb különbség az, hogy a kiegyensúlyozott egyenlet azt mutatja, hogy a rendszerben bekövetkezett összes reakció együttesen míg a nettó ionegyenlet csak azt a nettó reakciót mutatja, reakció.
Tartalomjegyzék
1. Áttekintés és kulcskülönbség
2. Mi a Balanced Equation
3. Mi a Net Ionikus egyenlet
4. Side by Side Összehasonlítás - Balanced Equation vs Net Ionikus egyenlet
5. Összefoglalás
Mi a Balanced Equation?
A kémiai reakciók nagyon fontosak egy adott rendszer viselkedésének megértéséhez. Ha a reakció megfelelő egyenletét írja, fel lehet ismerni a különböző fajok változásait a rendszerben. Az egyszerű reakciókhoz, mint a NaCl vízben való feloldása, az egyenlet könnyen megírható az adott reakció lehetséges termékének előrejelzésével. De más komplex reakciók esetén további vizsgálatokat kell végezni annak érdekében, hogy megtalálják az adott rendszer termékeit. De a legtöbb esetben az írott egyenlet nagy valószínűséggel kiegyensúlyozatlan, ami megnehezíti a rendszer kémiai viselkedését. Ezért a kiegyensúlyozatlan egyenleteknek kiegyensúlyozottnak kell lenniük. A kiegyensúlyozott egyenlet magában foglalja az összes rendszer reaktánsát és termékeit. Az egyenletet úgy írjuk le, hogy a reaktáns vegyületet molekulaként tekintjük. Például a KI és a PbNO 3 kiegyensúlyozott egyenlete (ha ezek vízzel reagáltak) lenne;

3 és KI aránynak 1: 2 arányban kell lennie, amikor ezeket a komponenseket hozzáadjuk a rendszerbe. Mi a Net Ion egyenlet?
A nettó ionos egyenlet csak a teljes reakciót mutatja a rendszerben. Ez magában foglalja az ionos fajokat és a képződött termékeket. De nem jelzi az összes olyan reakciót, amely egy adott rendszerben történt. Például ha két molekula reakciója van a víz mint tápközeg alkalmazásával, akkor a vegyületek feloldódhatnak vízben és ionokká válhatnak. Néhány ilyen ion részt vehet a reakcióban, de egyesek nem. Ezután a nettó ionos egyenlet csak azokat az ionokat foglalja magában, amelyek részt vettek a netreakcióban. Más ionokat, amelyeket nézői ionoknak neveznek, kiegyenlítik az egyenletből, hogy megkapják a nettó ionos egyenletet. Például ha KI és PbNO
3 vízben reagált, a nettó ionreakció lenne; Ez magában foglalja a K
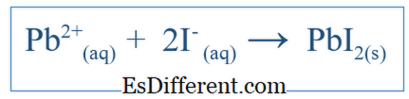
ion és NO3 - ionokat is, de ezek az ionok csak feloldódnak és nem vesznek részt a legfontosabb reakcióban; így nem szerepelnek a nettó ionreakcióban. Mi a különbség a kiegyenlített egyenlet és a nettó ionegyenlet között? - diff Artikkel Közel a táblázat előtt ->
Kiegyensúlyozott egyenlet vs nettó ionegyenlet
Minden alkalmazott komponenst a kiegyensúlyozott egyenletben reaktánsokként írunk.
Azok a reagensek, amelyek csak a nettó reakcióban vettek részt, a nettó ionreakcióban íródnak. |
|
| Termékek | A reakció végén a komponenseket kiegyensúlyozott egyenlet tartalmazza. |
| Egy nettó ionegyenletben csak a nettó végterméket írjuk. | |
| Részletek megadva | A kiegyensúlyozott egyenlet részletezi a rendszerben található összes fajról. |
| A nettó ionegyenlet csak a reakcióban részt vevő fajokról ad részleteket | |
| Összegzés - Egyenletes egyenlet vs nettó ionegyenlet | Ha bizonyos ionos vegyületeket adunk a vízhez, akkor szétesik és olyan ionokat képeznek, amelyek feloldódnak vízben. Ez anionokat és kationokat állít elő. A termelt fajok bemutatása a reakció befejezése és a reakció iránya után kémiai egyenlet írható. Ez az egyenlet kiegyensúlyozható, figyelembe véve az egyes fajok atomjainak számát, amelyek a nyíl két oldalán találhatók; néha még a fajok feltöltését is figyelembe kell venni. Ez kiegyensúlyozott kémiai egyenletet ad az adott rendszer számára. Azonban a nettó ionos egyenlet csak a reagált fajra vonatkozik. Amint korábban rámutattunk, a kiegyensúlyozott egyenlet és a nettó ionos egyenlet közötti legfontosabb különbség az, hogy a kiegyensúlyozott egyenlet egy rendszer összes reakcióját mutatja, míg a nettó ionegyenlet csak az adott reakció befejezésekor bekövetkezett nettó reakciót mutatja. |
Referenciák:
1. Chang, R., 2010. kémia. 10. ed. NewYork: McGraw-Hill.
2. Kémiai reakciók. (d.). 2017. május 26-án, a // www. ric. edu / kari / ptiskus / reakciók /
3. Teljes ionos és nettó ionos egyenletek. (d.). A letöltés dátuma: 2017 május 26, a // www. Khan Akadémia. org / tudomány / kémia / kémiai-reakciók-stoichiome / típusok-a-kémiai-reakciók / egy / teljes-ionos-és-net-ionos-egyenlet.


